
聯系我們
地址:長沙市岳麓區楓林三路500號高盛華成2棟2單元2805
郵編:410205
聯系人: 15973123761 (尹顯峰)
QQ:584473091
聯系人:18570397693 / 0731-83888701 (周小姐)
QQ:357013157
計算機化系統驗證(Computer System Validation, CSV):建立文件來證明系統的開發符合質量工程的原則,能夠提供滿足用戶需求的功能并且能夠長期穩定工作的過程。
計算機化系統生命周期:包括由概念提出,需求理解,經由開發、放行和投入使用,直至系統退役全過程。
良好自動化生產實踐指南(Good Automated Manufacturing Practice , GAMP):是由ISPE主編的實踐指南。自90年代以來,不斷改版的良好自動化生產實踐指南被廣泛使用并得到國際監管部門的公認,它是計算機化系統驗證的指導方針。現行版本為第5版,即GAMP5。
GxP:基本的國際制藥要求(法律或規范),包括但不限于:GMP藥品生產質量管理規范、GLP良好實驗室管理規范、GCP良好臨床實驗管理規范、GDP良好配送管理規范、GPP良好藥品安全管理規范等。
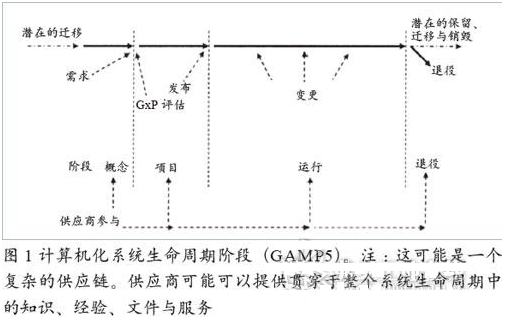
計算機化系統生命周期
計算機化系統生命周期包括從概念提出到系統退役的所有活動。由以下4個主要階段組成:概念提出;項目實施;系統運行;系統退役。
概念提出
在概念提出階段,公司會根據業務需求和收益來考慮是否要實現某一個或多個業務流程的自動化。通常,在這個階段會提出初始需求并考慮可能的解決方法。通過對范圍、成本和收益的初步認識,來決定是否需要進入到項目實施階段。
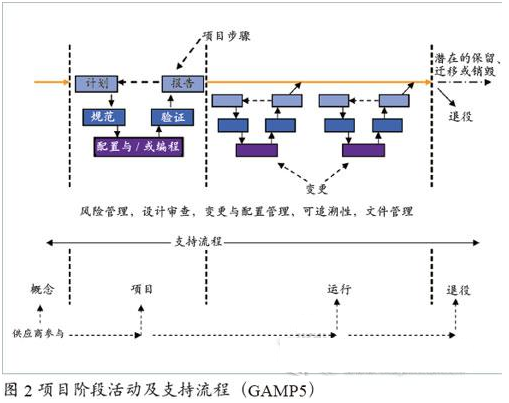
項目實施
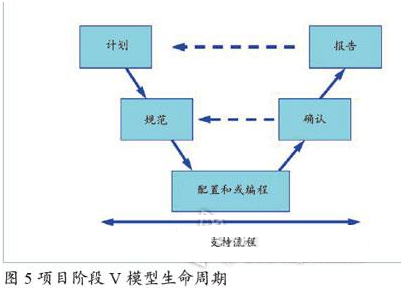
項目階段包括以下5個方面:
計劃(包括驗證計劃、供應商的評估和選擇以及質量及項目計劃);
規范(包括需求規范和設計規范);
配置和/或編程(包括源代碼審核以及軟硬件的集成過程);
驗證(包括模塊測試、集成測試和系統測試);
報告(包括驗收、放行與投入使用)。
當然,項目階段還包含風險管理、設計審查、變更和配置管理、可追溯性以及文件管理等在內的支持流程,參見圖2。
系統運行
系統運行通常是最長的階段,由既定的、及時更新的、可操作性的規程對其進行管理。保證系統處于受控(包括其安全性)、符合預期用途并且符合法規要求的狀態,需要對系統進行變更和配置管理。
系統退役
當一個計算機化系統的現行功能實施不再適用,或執行一個新系統替代現有系統的功能時,該系統就從實際使用中引退。此階段是生命周期的最后一個階段。
計算機化系統軟硬件分類
對計算機化系統進行軟硬件分類也是有效的質量風險管理的一部分(軟硬件類別越高,相對而言的復雜性和新穎性就越高,風險相對也就越高)。所以需要將軟硬件分類同供應商評估以及GxP風險評估聯系起來加以認識和理解,以上三者結合起來確定出一個適宜的驗證生命周期。
值得注意的是:軟硬件分類并沒有特別明確的界限(尤指軟件),因此并非意味著所有的軟硬件均可精確地劃分到某個特定的類別。
相對GAMP4、GAMP5軟件分類不再單獨將“類別2固件”作為一個類別,因為隨著科技的發展,固件的復雜程度越來越高,可根據其嵌入軟件的性質劃分到任何一個類別。
硬件分為兩個類別:標準硬件組件和定制硬件組件。
軟件分類:GAMP5中將軟件分為基礎設施軟件(1類)、不可配置軟件(3類)、可配置軟件(4類)和定制應用軟件(5類)這4個類別。
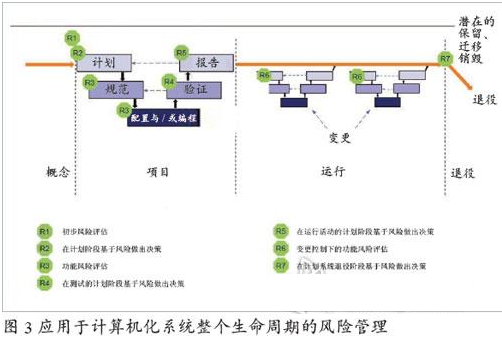
計算機化系統質量風險管理
計算機化系統的質量風險管理是一項非常重要而且有益的工作,它將貫穿于系統從初始概念提出直至最終系統退役的全過程。計算機化系統的風險管理是應用于系統整個生命周期,并針對患者安全、產品質量和數據完整性。具體如圖3所示:
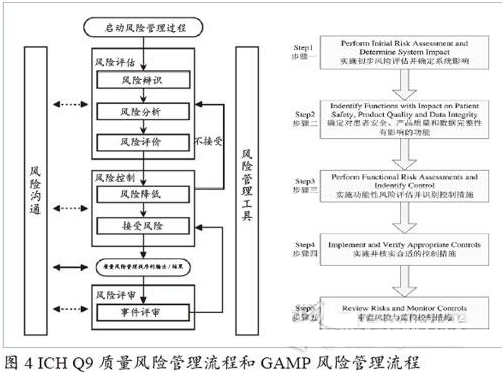
質量風險管理流程
計算機化系統質量風險管理采取了與ICH Q9質量風險管理相一致的框架進行風險評估、控制、交流與審查的系統化過程。如下圖4展示了GAMP用于質量風險管理的五步流程是如何應用ICH Q9質量風險管理流程來實現和維護系統合規性。
上述的五步流程將在計算機化系統生命周期的各個階段所實施。
風險管理工具一般采用失效模式影響分析(Failure Mode Effects Analysis, FMEA)進行計算機化系統的風險管理。
實施初步風險評估并確定系統影響:計算機化系統的初步風險評估是進行GxP關鍵性評估后再對GxP關鍵系統實施GxP影響分級。
確定對患者安全、產品質量和數據完整性有影響的功能:根據系統所要實現的功能從上述“GxP關鍵性”“影響級別”兩個層面上進行判斷和分析,從而確定并識別系統對于患者安全、產品質量和數據完整性有影響的功能。
實施并核實合適的控制措施:風險評估過程目的是采用合適的控制;依據所辨識出的風險級別可通過一組選項實現控制,這些選項包括但不局限以下:
修改工藝設計或者系統設計;
通過外部程序;
增加規范細節;
增加復查的級別和次數;
增加額外的更嚴格的驗證活動。
風險審查與監控措施:一旦確認和實施控制,將重新進行FMEA評估,以確保風險級別得到了有效降低并且已達到可接受的水平,同時對措施情況進行持續監控。
新建計算機化系統驗證
基于風險的可增減的生命周期活動對系統的整個生命周期均是適用的,本節主要針對計算機化系統的驗證工作在項目階段V模型生命周期(圖5)的可增減性策略。本節內容需要結合第3節和第4節一起來加以認識和理解:“軟硬件分類”其實也是“質量風險管理”工作的一部分,而“可增減的生命周期活動”是“基于風險”這一基礎而來的,“軟硬件分類”也是其可增減的典型決策因素之一。
活動可增減性的基礎和依據是質量風險管理,其決策因素主要來自如下3個方面:
系統的復雜性和新穎性(主要體現在軟硬件類別和項目大小);
系統的GxP風險(對患者安全、產品質量和數據完整性的影響);
供應商評估的結果(供應商的能力水平高低)。
基于風險的可增減性策略并非是為節約成本和減少工作量尋找借口,而是以一種高效的方式合理利用資源,從而提高系統的合規效率,并更加關注于患者及公眾安全這一最終目標上。
活動的可增減性主要體現在范圍和深度兩個層面上。對于范圍而言,其可增減性主要是在項目的規范階段和驗證階段的可伸縮;對于深度而言,整個項目的各階段活動(包括文件及實踐)深度均是一個可增減的過程。
供應商在系統的建造及合規方面扮演著非常重要的角色,因此對于供應商參與活動的平衡點也將是V模型生命周期中的一項重要工作。對于評估結果非常滿意的供應商,可以考慮盡可能多的讓供應商參與,從而充分利用其知識、經驗和文件,用以提高系統合規效率和避免不必要的重復工作。
如下展示的各階段的驗證活動(及文件)采用的是最大的生命周期(當然,如果認為在此活動基礎上風險仍不可控,則可以采取其他的或者更復雜的方式或活動來加以控制),基于系統實際的風險情況做出評估和分析后可以根據決策的結果來適當調整或減少某些活動的范圍和深度。
計劃階段:編寫審核并批準用戶需求說明并實施初步風險評估;進行供應商評估審計并選擇合適的供應商;編寫審核并批準驗證計劃;編寫審核并批準質量及項目計劃。
規范階段:編寫審核并批準功能說明;編寫審核并批準硬件設計說明,包括圖紙;編寫審核并批準軟件設計說明;編寫審核并批準軟件模塊說明;實施功能性風險評估和識別控制措施;編寫審核并批準設計確認方案,執行測試及審查結果。
配置和/或編程階段:訂購硬件;構建系統;開發軟件;制定配置管理計劃;集成系統。
驗證階段:軟件源代碼審核;編寫審核并批準軟件模塊測試方案,執行測試及審查結果;編寫審核并批準工廠驗收測試方案(硬件和功能);執行內部FAT預測試并審查結果(供應商內部的);執行并見證FAT測試并審查結果(被監管公司提供見證的);運至現場;安裝調試;編寫審核并批準SAT方案,執行測試及審查結果;編寫審核并批準IQ/OQ方案,執行測試及審查結果;編寫審核并批準可追溯矩陣。
報告階段:生成系統最終文件并進行審批;保證所有設計文件均為“竣工”版本;編寫技術手冊;為操作人員、工程師等進行培訓;生成最終驗證總結報告和移交檢查表并進行審查;完成移交;系統放行投入使用(運行階段持續維護)。

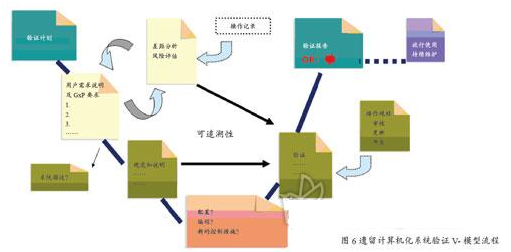
遺留計算機化系統驗證
近年來,由于快速發展的新技術以及監管的期望提高,同時由于GMP法規的升版等因素(如中國GMP2010版),被監管公司采取積極行動以保持其已有GxP相關系統處于驗證的狀態是至關重要的。
遺留系統的概念為未經驗證或沒有充足的證據證明其能滿足現有法規要求的一個受GxP監管的運行系統。其特點主要如下:
已在生產中使用的;
不認為是滿足監管期望的;
未經驗證的。
驗證的基本流程方法為:引入生命周期的概念;規范和驗證的方法;質量風險管理。圖6清晰展示了遺留計算機化系統驗證的流程和方法。
小結
計算機化系統驗證總體上講就是一個“基于風險的可增減的生命周期全過程”,本文從兩大方面講述了計算機化系統驗證:新建計算機化系統和遺留計算機化系統。同時對生命周期、軟硬件分類、質量風險管理等一些非常重要的知識、方法或理念進行了較為詳盡的介紹。
參考文獻
[1] 國家食品藥品監督管理局.藥品生產質量管理規范(2010年修訂).2010.
[2] US Code of Federal Regulations, Title 21, Food
and Drugs, 21CFR Part 11,Electronic Records, Electronic Signatures, 2011.
[3] ISPE GAMP5:A Risk-Based Apporach to Compliant
GxP Computerized Systems,International Society for Pharmaceutical
Engineering,Fifth Edition,February 2008. www.ispe.org
[4] EudraLex Volume 4 EU Guidelines to Good
Manufacturing Practice – Medicinal Products for Human and Veterinary Use,Annex
11- Computerized Systems, June 2011.
[5] ICH Q9 Quality Risk Management, November 2005,
4th phase.
如有計算機化系統管理方面的問題,可向長沙金領醫藥科技有限公司尹顯峰咨詢,手機號:15973123761。
上一篇:無
下一篇:計算機化系統軟件分類與驗證原則!

